2023年3月4日,深圳市新合生物医疗科技有限公司提交的国内首个mRNA肿瘤新抗原疫苗XH101注射液的新药临床试验(IND)申请获得国家药品监督管理局药品审评中心(CDE)受理【受理号:CXSL2300170】。该靶点为全球首创靶点,新合生物迎来RNA肿瘤治疗领域的里程碑进展。
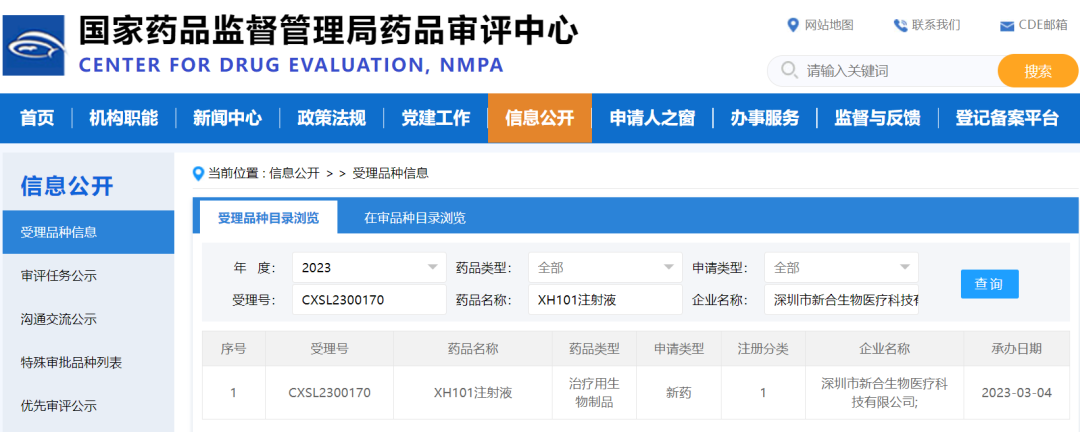
XH101注射液IND申请受理信息
XH101注射液是新合生物在全球首创的(First in Class)靶向胃癌公共新抗原的治疗性mRNA肿瘤疫苗。该公共新抗原是新合生物通过独家研发的肿瘤新抗原预测算法平台、免疫原性Elispot验证平台及细胞杀伤平台,从大量胃癌患者中筛选、预测、验证出的一段免疫原性强、覆盖度广的肿瘤公共新抗原序列。临床前研究数据显示XH101注射液能够有效激发患者的T细胞免疫应答及肿瘤细胞杀伤效应,具有显著的临床治疗潜力。

新合生物疫苗生产车间
胃癌是一种起源于胃黏膜上皮的恶性肿瘤,是我国较为高发的的恶性肿瘤之一。据国际癌症研究机构(IARC)统计,2020年全球约有110万胃癌病例,中国患者占据其中的43.9%,约48万例,位居全球第一。数据显示,2020年中国胃癌新发病例数高达48万,死亡病例数超过37万,亟需创新疗法缓解这一公共难题。
在此背景下,新合生物依托前沿的AI+RNA技术和顶尖的研发团队,针对胃癌自主研发了mRNA肿瘤公共新抗原疫苗XH101注射液。与传统药物相比,该疫苗具有更强的免疫原性,可诱发人体天然的免疫反应,不仅可以缩短疫苗制备周期,降低患者的治疗成本,还可以在患者体内产生持久有效的免疫记忆,为肿瘤防复发、防转移提供可能。同时,XH101注射液对晚期肿瘤和转移性肿瘤,还可起到有效抑制作用。

新合生物疫苗研发实验室
未来,新合生物希望通过持续研发为患者提供更多安全、有效的RNA创新药物,高质量地推动RNA创新药临床转化和应用,解决未被满足的临床需求,早日为患者带来更多、更优的治疗选择。
郑重声明:此文内容为本网站转载企业宣传资讯,目的在于传播更多信息,与本站立场无关。仅供读者参考,并请自行核实相关内容。